Afrontamos el Reglamento de productos sanitarios (MDR)
Los productos sanitarios se utilizan para atender a los pacientes con fines terapéuticos o diagnósticos. Un producto sanitario es un simple esparadrapo, pero también un artículo sanitario complejo o un implante, por ejemplo, una articulación artificial de cadera. Desde hace mucho tiempo, los fabricantes de todos los productos sanitarios deben cumplir los requisitos legales y normativos. En Alemania, la ley de productos sanitarios regula los pormenores. Esta, por su parte, aplica los requisitos europeos, establecidos en una directiva europea (Directiva de productos sanitarios o MDD, por sus siglas en inglés).
Cada país debe trasladar los requisitos de esta directiva a su propia legislación nacional. La Directiva europea describe que un producto sanitario comercializado en la UE debe cumplir determinados requisitos. Cuáles son en concreto depende de los riesgos que puedan derivarse del producto individual. Cuanto más complejo sea un producto, más detalladas son las especificaciones. Para facilitar la clasificación de los productos, estos se asignan a clases de riesgo.
En el caso de los productos de clasificación superior, el fabricante debe proporcionar pruebas detalladas al organismo notificado (organismo de inspección) conforme ha cumplido todos los requisitos. Entonces podrá asignar al producto la marca CE y llevarlo libremente a cualquier mercado comunitario o, dicho de otro modo, «comercializarlo». En el caso de los productos de menor riesgo (p. ej., productos de clase I), la responsabilidad es del propio fabricante.
El 26 de mayo de 2021, la antigua directiva europea MDD se sustituye por un nuevo reglamento, el Reglamento Europeo de productos Sanitarios, abreviado MDR. A diferencia de la directiva, este reglamento no se debe trasladar a las legislaciones nacionales, sino que tiene inmediatamente validez jurídica sistemática y es vinculante para todos los Estados miembros europeos.
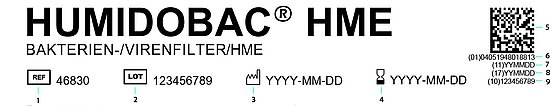
Ni siquiera notará la mayoría de los cambios. El foco de atención son los procesos internos y su organización. Casi todo lo relacionado con Reglamento Europeo de Productos Sanitarios (MDR) discurre en segundo plano. Sin embargo, con la entrada en vigor del nuevo reglamento en mayo de 2021 y la introducción de una nueva obligación de etiquetado asociada, la llamada UDI (Identificación Única de Producto), la etiqueta de nuestros productos cambiará. Además de la información habitual, como el número de artículo, el nombre del artículo o el fabricante, incluye un nuevo número de 14 dígitos bajo una matriz de datos para escanear.
Tanto el número como la matriz contienen toda la información importante en un código escaneable, para poder realizar un seguimiento detallado de cada producto sanitario. Esta identificación clara e internacionalmente uniforme de los productos sanitarios durante todo su ciclo de vida ofrece claras ventajas: registro rápido y sin errores en el proceso de fabricación, en el almacén, durante la preparación de pedidos y en el envío. Para usted como usuario, significa sobre todo una trazabilidad completa de su producto y, por tanto, una mayor transparencia y seguridad.
¿Qué significan las nuevas directrices MDR para FAHL y cómo se aplican estas medidas en el ámbito organizativo?
Nuestra gestora de calidad, Christa Peters, lo resume en pocas palabras.
La empresa Andreas Fahl Medizintechnik-Vertrieb GmbH se complace en afrontar estos nuevos retos del MDR y celebra la llegada de las nuevas directrices para una mayor seguridad de los pacientes. Por supuesto, seguimos ofreciendo toda la cartera de productos en el mercado conforme a los nuevos procedimientos de homologación. Contamos con equipos expeditivos en el área de la gestión de calidad y el desarrollo de productos, a los que formamos constantemente para aplicar los nuevos requisitos de forma selectiva.
Nuestro veterano organismo designado cuenta con la acreditación para realizar auditorías según el MDR. A finales de este año, nos auditará según el nuevo reglamento por primera vez. En el futuro, la seguridad del paciente seguirá ocupando, como siempre, un lugar central.


¿Qué es el MDR?
El MDR (Medical Device Regulation, Reglamento de productos sanitarios) es una nueva normativa de la Unión Europea en pro de una mayor seguridad de los pacientes. Sustituye la antigua directiva europea MDD (Medical Device Directive, Directiva sobre productos sanitarios). En varios cientos de páginas se describen los cambios que afectan todos los productos sanitarios, pero también los que formulan nuevas especificaciones solo para determinados grupos. En resumen, sin embargo, todos los fabricantes de productos sanitarios están ahora obligados a:
- ampliar la documentación de los datos relacionados con los productos,,
- intensificar la colaboración con los proveedores y supervisarlos con mayor empeño,,
- cambiar la asignación de productos —como el software— a clases de mayor riesgo,
- introducir un seguimiento de los productos en el mercado durante todo el ciclo de vida del producto y, como resultado, reevaluar periódicamente la seguridad del producto.
Una vez transcurrido el periodo de transición ampliado (para los productos de clasificación superior con un certificado MDD válido), todos los productos sanitarios deberán cumplir los requisitos del MDR como máximo el 27.05.2024. Algunos expertos y críticos alertan del riesgo de que algunos productos existente y probados puedan desaparecer del mercado debido a las exigencias significativamente mayores de la nueva legislación. Es el caso, en particular, de los productos nicho con que los fabricantes están representados en el mercado en un grado manejable, pero que exigirían el mismo esfuerzo que un producto de masas cuando se introduzca el MDR.